Bạn đã bao giờ dừng lại và tự hỏi, thế giới rộng lớn, đa dạng mà chúng ta đang sống được tạo nên từ những thứ gì chưa? Từ những ngọn núi hùng vĩ, dòng sông uốn lượn, không khí ta hít thở, đến chính cơ thể chúng ta – tất cả đều có nguồn gốc từ những thành phần vô cùng nhỏ bé, tưởng chừng như không thể nhìn thấy. Đó chính là thế giới kỳ diệu của phân tử và nguyên tử. Trong 50 từ đầu tiên này, chúng ta sẽ cùng nhau khám phá những “viên gạch” nền tảng này, tìm hiểu chúng là gì, chúng khác nhau ra sao và tại sao việc hiểu về phân tử và nguyên tử lại mở ra cánh cửa đến vô vàn kiến thức và ứng dụng trong cuộc sống hiện đại. Sẵn sàng cho một hành trình thu nhỏ để nhìn ngắm “trái tim” của vật chất chưa?
Nguyên Tử Là Gì? Khối Xây Dựng Cơ Bản Của Vật Chất
Nếu phải chọn ra một thứ làm nền tảng cho mọi vật chất tồn tại, đó chắc chắn phải là nguyên tử. Vậy, nguyên tử là gì? Đơn giản mà nói, nguyên tử là đơn vị cấu tạo cơ bản nhất của một nguyên tố hóa học, không thể phân chia bằng các phương pháp hóa học thông thường, nhưng vẫn giữ được tính chất hóa học của nguyên tố đó.
Hãy tưởng tượng bạn có một miếng vàng ròng. Cứ bẻ đôi nó ra mãi, bẻ nhỏ lại, cho đến khi bạn không thể bẻ được nữa bằng phản ứng hóa học thông thường. Cái hạt vàng nhỏ nhất còn giữ nguyên tính chất của vàng, đó chính là nguyên tử vàng. Khái niệm này đã được con người suy ngẫm từ rất lâu, từ thời Hy Lạp cổ đại với Democritus, nhưng mãi đến đầu thế kỷ 19, John Dalton mới đưa ra học thuyết nguyên tử hiện đại đầu tiên, coi nguyên tử như những quả cầu rắn, không thể phân chia. Ngày nay, chúng ta biết rằng nguyên tử phức tạp hơn thế rất nhiều.
Cấu Tạo “Siêu Nhỏ” Của Nguyên Tử
Tưởng tượng một sân vận động khổng lồ. Ở trung tâm là một viên bi rất nhỏ, đó là hạt nhân nguyên tử. Xung quanh sân vận động là những hạt bụi li ti, đó là các electron, chúng chuyển động không ngừng trong một “đám mây” xác suất nào đó. Phần lớn “sân vận động” là không gian trống rỗng! Đó là cấu trúc cơ bản của nguyên tử:
- Hạt nhân: Nằm ở trung tâm, mang điện tích dương. Hạt nhân chứa proton (mang điện tích dương) và neutron (không mang điện tích). Số proton trong hạt nhân quyết định đó là nguyên tố hóa học nào (ví dụ: 1 proton là Hydro, 6 proton là Carbon, 79 proton là Vàng). Tổng số proton và neutron quyết định khối lượng nguyên tử.
- Electron: Các hạt mang điện tích âm, chuyển động rất nhanh xung quanh hạt nhân trong các vùng không gian gọi là obitan nguyên tử (hay lớp electron). Điện tích âm của electron cân bằng điện tích dương của proton (trong nguyên tử trung hòa), làm cho nguyên tử tổng thể không mang điện. Các electron ở lớp ngoài cùng đóng vai trò quan trọng trong việc hình thành liên kết hóa học.
Sự tương tác giữa hạt nhân và electron thông qua lực điện từ giữ cho nguyên tử liên kết với nhau. Mỗi nguyên tố hóa học được đặc trưng bởi số proton trong hạt nhân của nó. Điều này giải thích tại sao bảng tuần hoàn các nguyên tố lại được sắp xếp theo số thứ tự tăng dần của proton (số nguyên tử).
Hạt nhân cũng là nơi chứa hầu hết khối lượng của nguyên tử. Mặc dù electron chiếm không gian lớn xung quanh hạt nhân, khối lượng của chúng lại rất nhỏ so với proton và neutron. Đây là một điểm thú vị: vật chất chủ yếu là không gian trống!
Hiểu về cấu tạo nguyên tử giúp chúng ta giải thích tại sao các nguyên tố lại có tính chất khác nhau. Ví dụ, số electron ở lớp ngoài cùng (electron hóa trị) quyết định cách nguyên tử đó tương tác với các nguyên tử khác, từ đó hình thành liên kết hóa học.
Nguyên tử của cùng một nguyên tố có thể có số neutron khác nhau, chúng được gọi là đồng vị. Ví dụ, Hydro thông thường có 1 proton và không có neutron, nhưng cũng có đồng vị Deuterium (1 proton, 1 neutron) và Tritium (1 proton, 2 neutron). Các đồng vị có tính chất hóa học gần giống nhau nhưng khác nhau về khối lượng và tính phóng xạ (nếu có).
Phân Tử Là Gì? Khi Nguyên Tử Kết Hợp Với Nhau
Nếu nguyên tử là những viên gạch xây dựng cơ bản, thì phân tử chính là những “ngôi nhà” hoặc “công trình” được xây từ những viên gạch ấy. Vậy, phân tử là gì? Phân tử là một nhóm gồm hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học, đủ bền vững để tồn tại như một thực thể độc lập và mang đầy đủ tính chất hóa học của chất đó.
Nước (H2O) là một ví dụ kinh điển về phân tử. Mỗi phân tử nước gồm 2 nguyên tử Hydro liên kết với 1 nguyên tử Oxy. Dù bạn chia nhỏ nước đến mức nào, hạt nhỏ nhất còn giữ tính chất “là nước” chính là phân tử H2O. Nếu bạn chia nhỏ hơn nữa, bạn sẽ chỉ còn lại các nguyên tử Hydro và Oxy riêng lẻ, chúng không còn tính chất của nước nữa.
Khác với nguyên tử là đơn vị của nguyên tố, phân tử là đơn vị cấu tạo của chất (đơn chất hoặc hợp chất). Một phân tử có thể được tạo thành từ các nguyên tử cùng loại (ví dụ: phân tử Oxy O2 gồm 2 nguyên tử Oxy liên kết với nhau – đây là phân tử của đơn chất) hoặc các nguyên tử khác loại (ví dụ: phân tử Carbon Dioxide CO2 gồm 1 nguyên tử Carbon và 2 nguyên tử Oxy – đây là phân tử của hợp chất).
Sự hình thành phân tử từ nguyên tử là quá trình diễn ra thông qua liên kết hóa học. Có nhiều loại liên kết khác nhau, phổ biến nhất là liên kết cộng hóa trị (các nguyên tử “chia sẻ” electron với nhau) và liên kết ion (một nguyên tử “cho” electron cho nguyên tử khác, tạo thành các ion trái dấu hút nhau). Chính cách thức liên kết này quyết định hình dạng, tính chất và độ bền vững của phân tử.
Phân Loại Các Dạng Phân Tử Phổ Biến
Thế giới phân tử vô cùng đa dạng, từ những phân tử đơn giản chỉ gồm vài nguyên tử đến những phân tử phức tạp khổng lồ như DNA hay protein, chứa hàng triệu nguyên tử. Tuy nhiên, chúng ta có thể phân loại chúng dựa trên thành phần:
- Phân tử đơn chất: Được tạo thành từ các nguyên tử của cùng một nguyên tố hóa học. Ví dụ: O2 (Oxy), N2 (Nitơ), S8 (Lưu huỳnh), P4 (Phốt pho trắng), Au (Vàng, ở trạng thái rắn kim loại, nguyên tử liên kết thành mạng tinh thể, nhưng đôi khi vẫn coi là “phân tử” đơn nhân trong một số ngữ cảnh).
- Phân tử hợp chất: Được tạo thành từ các nguyên tử của hai hay nhiều nguyên tố hóa học khác nhau liên kết lại theo một tỷ lệ xác định. Ví dụ: H2O (Nước), CO2 (Carbon Dioxide), NaCl (Muối ăn), C6H12O6 (Đường Glucose).
- Phân tử lớn (Macromolecules) hoặc Polyme: Những phân tử cực kỳ lớn, được tạo thành từ sự lặp lại của nhiều đơn vị nhỏ hơn (monomer) liên kết với nhau. Ví dụ: protein, tinh bột, nhựa, cao su, DNA.
Mỗi loại phân tử có cấu trúc và tính chất riêng biệt, quyết định đặc điểm của chất mà chúng tạo nên. Ví dụ, hình dạng của phân tử nước (góc H-O-H là khoảng 104.5 độ, phân tử có tính phân cực) quyết định nhiều tính chất đặc trưng của nước như khả năng hòa tan nhiều chất, sức căng bề mặt, điểm sôi tương đối cao so với các phân tử có khối lượng tương đương.
Sự hiểu biết về cấu trúc và tương tác của phân tử là nền tảng cho hóa học hữu cơ, hóa học vô cơ, hóa sinh và nhiều lĩnh vực khoa học khác. Nó giúp chúng ta giải thích tại sao một chất lại ở thể rắn, lỏng, hay khí ở nhiệt độ phòng, tại sao chúng lại phản ứng với nhau theo cách này hay cách khác, và làm thế nào để tạo ra các vật liệu mới với tính chất mong muốn.
 Sơ đồ đơn giản minh họa cấu tạo nguyên tử gồm hạt nhân và các electron quay xung quanh
Sơ đồ đơn giản minh họa cấu tạo nguyên tử gồm hạt nhân và các electron quay xung quanh
Điểm Khác Nhau Cốt Lõi Giữa Nguyên Tử Và Phân Tử Là Gì?
Nguyên tử và phân tử tuy có mối liên hệ chặt chẽ nhưng là hai khái niệm khác biệt quan trọng trong hóa học và vật lý. Việc nắm rõ sự khác biệt này là chìa khóa để hiểu về cấu tạo và tính chất của vật chất.
Sự khác biệt chính nằm ở cấu trúc, thành phần và vai trò của chúng trong hóa học:
| Đặc Điểm | Nguyên Tử | Phân Tử |
|---|---|---|
| Cấu tạo | Gồm hạt nhân (proton, neutron) và electron. | Gồm hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học. |
| Thành phần | Đơn vị nhỏ nhất của một nguyên tố hóa học. | Đơn vị nhỏ nhất của một chất (đơn chất hoặc hợp chất). |
| Tính chất | Giữ tính chất hóa học của nguyên tố. | Giữ tính chất hóa học của chất mà nó tạo nên. |
| Tồn tại | Một số nguyên tử có thể tồn tại độc lập (khí hiếm). Đa số không bền và có xu hướng liên kết. | Có thể tồn tại độc lập trong điều kiện thường. |
| Phân chia | Không thể phân chia bằng phương pháp hóa học thông thường (chỉ bằng phản ứng hạt nhân). | Có thể phân chia thành các nguyên tử cấu thành bằng phản ứng hóa học. |
| Khối lượng | Khối lượng nguyên tử. | Khối lượng phân tử (tổng khối lượng các nguyên tử trong phân tử). |
| Kích thước | Nhỏ hơn (khoảng 10⁻¹⁰ m). | Lớn hơn hoặc bằng kích thước nguyên tử (khoảng 10⁻¹⁰ đến 10⁻⁷ m hoặc hơn). |
Nói một cách ví von dễ hiểu: nếu nguyên tử là các chữ cái (A, B, C…), thì phân tử là các từ được ghép từ những chữ cái đó (ví dụ: từ “NHÀ” được ghép từ N, H, A). Một chữ cái có thể đứng một mình (như A), nhưng nó có ý nghĩa khác so với khi nó kết hợp với chữ khác để tạo thành từ. Tương tự, một nguyên tử có thể tồn tại độc lập (như nguyên tử Heli He), nhưng tính chất của nó rất khác so với khi nó liên kết với nguyên tử khác tạo thành phân tử (ví dụ: nguyên tử Hydro H không bền khi đứng một mình, nhưng kết hợp thành phân tử H2 lại rất bền và có tính chất khác).
Sự phân biệt này cực kỳ quan trọng trong hóa học. Khi nói về phản ứng hóa học, chúng ta thường mô tả sự sắp xếp lại của các nguyên tử để tạo thành các phân tử mới, chứ không phải sự biến đổi của chính các nguyên tử (trừ phản ứng hạt nhân).
Để hiểu rõ hơn về ranh giới và sự khác biệt cụ thể giữa hai khái niệm nền tảng này, bạn có thể tham khảo thêm các bài viết chuyên sâu về phân biệt nguyên tử và phân tử, nơi chúng ta đi sâu vào từng khía cạnh một cách chi tiết hơn. Kiến thức này là bước đệm vững chắc để tiếp cận các khái niệm hóa học phức tạp hơn sau này.
Mối Quan Hệ “Mật Thiết” Giữa Nguyên Tử Và Phân Tử
Nguyên tử là nền tảng, là “nguyên liệu” để tạo nên phân tử. Phân tử là “sản phẩm” của sự kết hợp giữa các nguyên tử thông qua các lực hấp dẫn gọi là liên kết hóa học. Mối quan hệ này giống như các viên gạch (nguyên tử) được gắn kết bằng vữa (liên kết hóa học) để tạo thành một bức tường hay một ngôi nhà (phân tử).
Quá trình nguyên tử hình thành phân tử diễn ra như thế nào? Nó dựa trên quy luật tự nhiên mà các nguyên tử có xu hướng đạt đến trạng thái năng lượng thấp nhất, hay nói cách khác là đạt đến cấu hình electron bền vững giống khí hiếm. Để làm được điều này, chúng sẽ tương tác với nhau bằng cách cho, nhận, hoặc góp chung electron ở lớp vỏ ngoài cùng để tạo thành các liên kết.
Ví dụ đơn giản nhất là sự hình thành phân tử Hydro (H2). Mỗi nguyên tử Hydro có 1 electron. Để đạt cấu hình bền giống Heli (2 electron ở lớp vỏ ngoài cùng), hai nguyên tử Hydro sẽ góp chung mỗi cái 1 electron, tạo thành một cặp electron dùng chung. Cặp electron này nằm giữa hai hạt nhân Hydro, hút cả hai hạt nhân và giữ chúng lại với nhau – đó chính là liên kết cộng hóa trị. Kết quả là chúng ta có phân tử H2 bền vững.
Một ví dụ khác là sự hình thành muối ăn (NaCl). Nguyên tử Natri (Na) có 1 electron ở lớp vỏ ngoài cùng, còn nguyên tử Clo (Cl) có 7 electron ở lớp vỏ ngoài cùng. Natri có xu hướng nhường 1 electron để trở thành ion Na⁺ (mang điện dương, cấu hình bền), còn Clo có xu hướng nhận 1 electron để trở thành ion Cl⁻ (mang điện âm, cấu hình bền). Ion Na⁺ và Cl⁻ mang điện tích trái dấu nên hút nhau bằng lực tĩnh điện, tạo thành liên kết ion. Ở trạng thái rắn, các ion này sắp xếp thành mạng lưới tinh thể khổng lồ, không tồn tại dưới dạng phân tử NaCl riêng lẻ, nhưng trong trạng thái hơi, NaCl có thể tồn tại dưới dạng phân tử. Tuy nhiên, khái niệm phân tử thường được áp dụng rõ rệt hơn cho các chất có liên kết cộng hóa trị.
Sự đa dạng của phân tử đến từ sự kết hợp của các nguyên tố khác nhau và các kiểu liên kết khác nhau. Cùng là nguyên tử Carbon và Oxy, nhưng tỷ lệ khác nhau tạo nên Carbon Monoxide (CO) và Carbon Dioxide (CO2) với tính chất hoàn toàn khác biệt (CO là khí độc, CO2 là khí nhà kính không độc).
Hiểu được mối quan hệ này giúp chúng ta dự đoán và giải thích tại sao các chất lại tồn tại ở dạng phân tử này hay phân tử khác, và làm thế nào để chúng ta có thể điều khiển các phản ứng hóa học để tạo ra các chất mới có ích cho đời sống.
Tại Sao Việc Hiểu Về Phân Tử Và Nguyên Tử Lại Quan Trọng?
Nghe có vẻ “cao siêu” và chỉ dành cho nhà khoa học, nhưng kiến thức về phân tử và nguyên tử lại là chìa khóa để giải mã và làm chủ thế giới vật chất quanh ta. Tại sao ư?
Thứ nhất, chúng là nền tảng của mọi ngành khoa học tự nhiên. Hóa học, vật lý, sinh học, khoa học vật liệu, địa chất học… tất cả đều dựa trên sự tương tác và hành vi của nguyên tử và phân tử. Không hiểu về chúng, bạn không thể hiểu sâu sắc bất kỳ hiện tượng nào trong tự nhiên, từ việc tại sao nước đóng băng ở 0°C đến cách cây quang hợp hay cách tế bào hoạt động.
Thứ hai, kiến thức này mở đường cho công nghệ và đổi mới. Từ việc chế tạo vật liệu mới có tính năng siêu việt (như vật liệu bán dẫn, vật liệu polyme tiên tiến) đến phát triển thuốc chữa bệnh (dựa trên cách các phân tử thuốc tương tác với các phân tử sinh học trong cơ thể), hay công nghệ nano (thao tác trên cấp độ nguyên tử và phân tử), tất cả đều xuất phát từ sự hiểu biết sâu sắc về thế giới vi mô này.
Thứ ba, nó giúp chúng ta giải thích các hiện tượng đời thường. Tại sao đường tan trong nước? Tại sao nước có thể dập tắt lửa? Tại sao sắt bị gỉ? Tất cả những câu hỏi “tại sao” trong cuộc sống hàng ngày đều có thể được lý giải bằng cách xem xét sự tương tác ở cấp độ phân tử và nguyên tử.
Hiểu về cấu tạo và tính chất của phân tử và nguyên tử không chỉ là việc học thuộc lòng các khái niệm khô khan, mà là việc xây dựng một “bản đồ” tư duy về cách thế giới vật chất vận hành. Nó rèn luyện khả năng phân tích, suy luận và nhìn nhận vấn đề từ cấp độ cơ bản nhất.
Áp Dụng Kiến Thức Nguyên Tử, Phân Tử Trong Đời Sống Hàng Ngày
Bạn nghĩ rằng nguyên tử và phân tử chỉ tồn tại trong phòng thí nghiệm? Sai rồi! Chúng hiện diện và chi phối mọi thứ quanh bạn, từ lúc bạn thức dậy đến khi đi ngủ:
- Hơi thở: Oxy (O2) bạn hít vào và Carbon Dioxide (CO2) bạn thở ra đều là các phân tử. Quá trình trao đổi khí ở phổi là sự di chuyển của các phân tử Oxy và CO2 qua màng tế bào.
- Nước uống: Nước (H2O) là một phân tử. Tính chất đặc biệt của phân tử nước (liên kết Hydro) quyết định khả năng hòa tan nhiều chất, làm cho nước trở thành dung môi của sự sống.
- Đồ ăn: Đường (C12H22O11), muối (NaCl), protein, tinh bột… tất cả đều là các phân tử phức tạp hoặc được tạo thành từ các phân tử. Việc nấu ăn là quá trình làm thay đổi cấu trúc và tính chất của các phân tử trong thực phẩm.
- Quần áo: Vải cotton làm từ cellulose (một polyme), vải polyester làm từ các polyme tổng hợp. Độ bền, khả năng thấm hút, màu sắc của vải đều phụ thuộc vào loại và cấu trúc của các phân tử tạo nên sợi vải.
- Thiết bị điện tử: Các vi mạch trong điện thoại, máy tính làm từ silicon – một nguyên tố. Tính chất bán dẫn của silicon phụ thuộc vào cấu trúc nguyên tử và cách các nguyên tử silicon liên kết với nhau. Dây dẫn điện thường làm từ đồng, sự dẫn điện hiệu quả của đồng liên quan trực tiếp đến cách các electron di chuyển qua mạng lưới nguyên tử đồng.
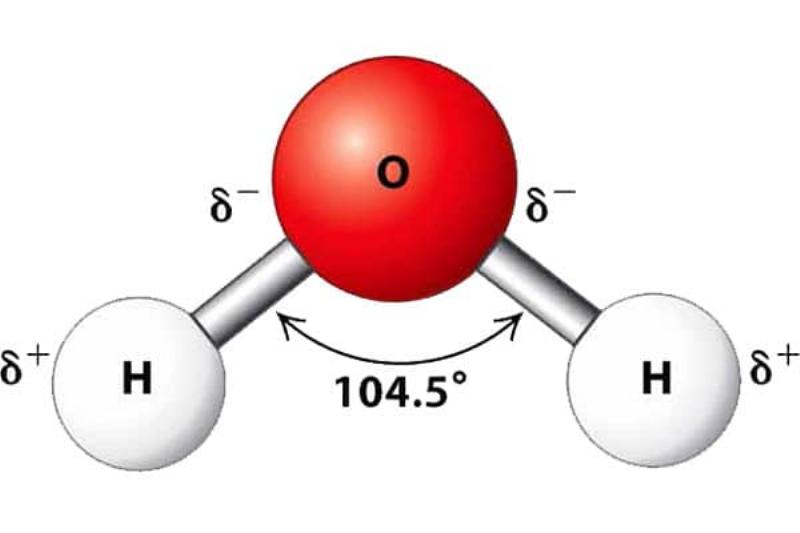 Hình ảnh minh họa cấu tạo phân tử nước H2O với hai nguyên tử hydro và một nguyên tử oxy
Hình ảnh minh họa cấu tạo phân tử nước H2O với hai nguyên tử hydro và một nguyên tử oxy
Mọi sự thay đổi trong tự nhiên, từ quá trình quang hợp của cây xanh, sự tiêu hóa thức ăn trong cơ thể, đến sự ăn mòn kim loại hay sự cháy, đều là kết quả của sự tương tác, sắp xếp lại của các nguyên tử và phân tử. Việc hiểu được những nguyên lý cơ bản này giúp chúng ta không chỉ giải thích thế giới mà còn có thể dự đoán và kiểm soát nó.
Ví dụ, hiểu về cách các nguyên tử và phân tử tương tác trong vật liệu bán dẫn cho phép các kỹ sư thiết kế và chế tạo chip máy tính ngày càng nhỏ gọn và mạnh mẽ hơn. Hiểu về cấu trúc phân tử của thuốc và cách chúng tương tác với protein trong cơ thể giúp các nhà dược học phát triển những loại thuốc hiệu quả và ít tác dụng phụ hơn. Thậm chí, việc tìm hiểu về các loại liên kết giữa các nguyên tử và phân tử trong các loại vật liệu khác nhau còn liên quan đến cả việc lựa chọn vật liệu phù hợp cho các ứng dụng kỹ thuật, chẳng hạn như vật liệu cách điện cho dây dẫn, hay vật liệu siêu dẫn cho các công nghệ tiên tiến, vốn là những chủ đề chuyên sâu mà bạn có thể tìm hiểu thêm.
Giải Đáp Các Câu Hỏi Thường Gặp Về Phân Tử Và Nguyên Tử
Khi mới bắt đầu tìm hiểu về thế giới vi mô này, chắc hẳn bạn sẽ có không ít thắc mắc. Dưới đây là một số câu hỏi thường gặp và giải đáp ngắn gọn, dễ hiểu:
Nguyên tố hóa học khác gì nguyên tử?
Nguyên tố hóa học là một loại vật chất thuần khiết chỉ chứa duy nhất một loại nguyên tử, được xác định bởi số proton trong hạt nhân. Còn nguyên tử là hạt vật chất nhỏ nhất đặc trưng cho nguyên tố đó, giữ nguyên tính chất hóa học của nguyên tố khi tham gia liên kết. Ví dụ: Oxy là nguyên tố hóa học (tập hợp tất cả các nguyên tử có 8 proton). Nguyên tử Oxy là một hạt cụ thể có 8 proton.
Có bao nhiêu loại nguyên tử?
Số loại nguyên tử chính là số lượng nguyên tố hóa học đã được phát hiện và công nhận. Hiện tại có 118 nguyên tố trong bảng tuần hoàn. Do đó, có 118 loại nguyên tử cơ bản khác nhau, phân biệt bởi số proton của chúng.
Phân tử có thể bị chia nhỏ không?
Có, phân tử có thể bị chia nhỏ thành các nguyên tử cấu thành thông qua các phản ứng hóa học, ví dụ như phân hủy hoặc điện phân. Khi phân tử nước (H2O) bị điện phân, nó tách thành khí Hydro (H2) và khí Oxy (O2), tức là các nguyên tử Hydro và Oxy đã tách rời liên kết trong phân tử nước và tạo liên kết mới.
Nguyên tử có thể bị chia nhỏ không?
Bằng phương pháp hóa học thông thường thì không. Nguyên tử là đơn vị nhỏ nhất giữ tính chất hóa học của nguyên tố. Tuy nhiên, nguyên tử có thể bị “phá vỡ” hoặc biến đổi hạt nhân thông qua các phản ứng vật lý năng lượng cao như phản ứng hạt nhân (phân hạch, tổng hợp hạt nhân), chia nhỏ thành các hạt hạ nguyên tử như proton, neutron, electron, và các hạt nhỏ hơn nữa.
Đơn vị đo khối lượng của chúng là gì?
Khối lượng của nguyên tử và phân tử rất nhỏ, nên người ta dùng đơn vị đo riêng. Đơn vị phổ biến là đơn vị khối lượng nguyên tử (amu), còn gọi là Dalton (Da). 1 amu xấp xỉ bằng 1/12 khối lượng của một nguyên tử Carbon-12. Khối lượng nguyên tử và phân tử thường được tính bằng amu, ví dụ khối lượng nguyên tử Carbon xấp xỉ 12 amu, khối lượng phân tử nước (H2O) xấp xỉ 18 amu (tổng của 2 nguyên tử Hydro ~1 amu mỗi loại và 1 nguyên tử Oxy ~16 amu). Nếu bạn quan tâm chi tiết hơn về cách tính và ý nghĩa của đơn vị đo này, bạn có thể tìm hiểu thêm về đơn vị của phân tử khối.
Những Lầm Tưởng Phổ Biến Về Phân Tử Và Nguyên Tử
Mặc dù là khái niệm cơ bản, nhưng không phải ai cũng hiểu đúng hoàn toàn về nguyên tử và phân tử. Có một vài lầm tưởng khá phổ biến:
- Nguyên tử là “viên bi” đặc, rắn chắc: Học thuyết Dalton ban đầu coi nguyên tử như quả cầu rắn. Tuy nhiên, mô hình nguyên tử hiện đại cho thấy nguyên tử chủ yếu là không gian trống, với hạt nhân nhỏ bé ở trung tâm và các electron chuyển động xung quanh. Nếu hạt nhân to bằng quả bóng tennis, thì electron gần nhất có thể cách xa đến vài kilômét!
- Nguyên tử không thể chia nhỏ được: Như đã nói ở trên, điều này chỉ đúng với các phản ứng hóa học thông thường. Trong vật lý hạt nhân, nguyên tử hoàn toàn có thể bị phân rã hoặc biến đổi.
- Phân tử luôn là sự kết hợp của các nguyên tử khác nhau: Không hẳn. Phân tử của các đơn chất như Oxy (O2), Nitơ (N2), Lưu huỳnh (S8) được tạo thành từ các nguyên tử cùng loại liên kết với nhau.
- Mọi chất đều tồn tại dưới dạng phân tử: Một số chất, đặc biệt là các hợp chất ion (như muối ăn NaCl ở trạng thái rắn) hoặc kim loại, không tồn tại dưới dạng các phân tử riêng lẻ trong mạng lưới tinh thể. Thay vào đó, chúng tạo thành mạng lưới ion hoặc mạng lưới nguyên tử khổng lồ. Khái niệm “phân tử” phù hợp nhất để mô tả các chất có liên kết cộng hóa trị, thường tồn tại ở thể khí, lỏng hoặc rắn có nhiệt độ nóng chảy, sôi thấp.
- Phân tử và nguyên tử là tĩnh: Không. Ngay cả trong chất rắn, các nguyên tử và phân tử luôn dao động xung quanh vị trí cân bằng của chúng. Trong chất lỏng và khí, chúng chuyển động hỗn loạn không ngừng. Năng lượng (nhiệt độ) làm tăng cường độ chuyển động này.
Việc nhận diện và sửa chữa những lầm tưởng này giúp chúng ta có cái nhìn chính xác và khoa học hơn về cấu tạo vật chất.
Từ Góc Nhìn Của Chuyên Gia: Hiểu Sâu Hơn Về Thế Giới Vi Mô
Để có cái nhìn chuyên sâu hơn về sự kỳ diệu của thế giới vi mô, chúng ta hãy cùng lắng nghe ý kiến từ các chuyên gia giả định trong lĩnh vực khoa học cơ bản:
PGS. TS. Nguyễn Văn An, một nhà Vật lý lý thuyết với nhiều năm nghiên cứu về cấu trúc hạt nhân và tương tác cơ bản, chia sẻ: “Thế giới của nguyên tử và phân tử ẩn chứa những định luật vật lý vô cùng đẹp đẽ và phức tạp. Từ cách các electron “nhảy múa” quanh hạt nhân theo quy luật lượng tử, đến cách các nguyên tử liên kết tạo thành phân tử thông qua trao đổi năng lượng, mỗi tương tác nhỏ bé đó lại định hình nên tính chất vĩ mô của vật chất mà chúng ta quan sát được hàng ngày. Hiểu về chúng là hiểu về bản chất sâu xa nhất của vũ trụ.”
Bên cạnh đó, TS. Lê Thị Mai, chuyên gia hàng đầu về Hóa học vật liệu, người đã dành cả sự nghiệp nghiên cứu về cách thiết kế và tổng hợp vật liệu mới dựa trên cấu trúc phân tử, cũng nhấn mạnh tầm quan trọng của kiến thức này: “Trong lĩnh vực vật liệu, việc hiểu rõ cách các nguyên tử liên kết để tạo thành phân tử, và cách các phân tử này sắp xếp với nhau, là yếu tố sống còn. Muốn tạo ra một loại nhựa bền hơn, một loại gốm chịu nhiệt tốt hơn, hay một vật liệu dẫn điện hiệu quả hơn, chúng ta cần ‘điều khiển’ chúng ở cấp độ phân tử. Kiến thức về phân tử và nguyên tử không chỉ là lý thuyết suông, nó là công cụ mạnh mẽ để kiến tạo tương lai.”
Những góc nhìn từ chuyên gia cho thấy rằng, dù có vẻ trừu tượng, nhưng việc nghiên cứu và hiểu về phân tử và nguyên tử có ý nghĩa thực tiễn vô cùng to lớn, là động lực cho sự phát triển của khoa học và công nghệ.
Khám Phá Thế Giới Vi Mô Qua Lăng Kính Khoa Học
Hành trình khám phá thế giới phân tử và nguyên tử không dừng lại ở việc định nghĩa hay phân biệt chúng. Đó là cánh cửa mở ra vô vàn lĩnh vực nghiên cứu hấp dẫn khác. Từ hóa học, nơi bạn học cách các phân tử tương tác trong các phản ứng; đến vật lý, nơi bạn đi sâu vào cấu trúc hạt nhân, các hạt hạ nguyên tử và các định luật chi phối hành vi của chúng; hay sinh học, nơi bạn khám phá các phân tử “sự sống” phức tạp như protein và DNA.
Mỗi chất liệu, mỗi hiện tượng tự nhiên đều là minh chứng sống động cho sự kỳ diệu của nguyên tử và phân tử. Tại sao kim cương lại cứng như vậy? Vì các nguyên tử Carbon liên kết với nhau theo một cấu trúc mạng lưới cực kỳ bền vững. Tại sao nước lại giãn nở khi đóng băng? Vì các phân tử nước sắp xếp thành một cấu trúc mạng lưới tinh thể có khoảng trống lớn hơn so với trạng thái lỏng. Mọi tính chất bạn thấy, sờ, ngửi, nếm đều là kết quả trực tiếp từ cách các nguyên tử và phân tử tương tác ở cấp độ vi mô.
Hiểu biết về nguyên tử và phân tử là bước khởi đầu cho mọi sự khám phá về thế giới vật chất. Nó giúp chúng ta không còn nhìn thế giới một cách hời hợt, mà có thể nhìn xuyên qua bề mặt, đi sâu vào bản chất cấu tạo nên vạn vật. Đây là kiến thức nền tảng không thể thiếu cho bất kỳ ai muốn theo đuổi các ngành khoa học kỹ thuật.
Hành Trình Tiếp Theo Của Bạn: Từ Lý Thuyết Đến Thực Tế
Việc tìm hiểu về phân tử và nguyên tử không chỉ dừng lại ở bài viết này. Kiến thức này là một hành trình kéo dài, đòi hỏi sự tò mò và sẵn sàng đào sâu hơn nữa. Bạn có thể tiếp tục khám phá qua sách giáo khoa, các khóa học trực tuyến, video giáo dục, hoặc thậm chí là các bảo tàng khoa học.
Hãy thử nhìn những vật dụng quen thuộc quanh bạn dưới một góc độ mới. Chiếc bút bi bạn đang cầm, cái bàn bạn đang ngồi, không khí bạn đang hít thở – tất cả đều là tập hợp của vô số nguyên tử và phân tử đang tương tác không ngừng nghỉ. Sự thay đổi trạng thái của vật chất (nước đá tan chảy, nước bay hơi), các phản ứng hóa học (thức ăn bị ôi thiu, bật lửa cháy), hay các hiện tượng vật lý (dòng điện chạy qua dây dẫn) – tất cả đều có thể được giải thích bằng cách áp dụng kiến thức cơ bản về thế giới vi mô này.
Thậm chí, những khái niệm phức tạp hơn trong lĩnh vực vật lý và khoa học vật liệu, như lý thuyết đằng sau hiện tượng siêu dẫn là hiện tượng đáng kinh ngạc hay cách lựa chọn vật liệu tối ưu cho các ứng dụng thực tế như trong bảng giá dây điện trần phú, đều bắt nguồn từ sự hiểu biết sâu sắc về cấu trúc và tương tác của các hạt ở cấp độ nguyên tử và phân tử.
Đừng ngần ngại đặt câu hỏi và tìm kiếm câu trả lời. Thế giới vi mô của phân tử và nguyên tử là một vũ trụ thu nhỏ đầy bất ngờ và thú vị, chờ đợi bạn khám phá. Càng hiểu sâu, bạn sẽ càng thấy trân trọng và kinh ngạc trước sự phức tạp và hài hòa của thế giới tự nhiên.
Khám Phá Tính Chất Các Chất Ở Cấp Độ Nguyên Tử, Phân Tử
Mỗi chất trên đời này lại có tính chất riêng biệt: nước thì lỏng, đá thì rắn, không khí thì khí, sắt thì dẫn điện, gỗ thì cách điện. Tại sao lại có sự khác biệt lớn đến vậy? Câu trả lời nằm ở cách các nguyên tử và phân tử cấu tạo nên chúng và cách chúng tương tác với nhau.
Ví dụ:
- Trạng thái vật chất (Rắn, Lỏng, Khí): Sự khác biệt cơ bản giữa ba trạng thái này là khoảng cách và mức độ chuyển động của các phân tử (hoặc nguyên tử trong trường hợp khí hiếm và kim loại). Trong chất rắn, các hạt sắp xếp trật tự và dao động quanh vị trí cố định. Trong chất lỏng, các hạt gần nhau nhưng có thể trượt lên nhau. Trong chất khí, các hạt ở rất xa nhau và chuyển động hỗn loạn.
- Độ cứng: Phụ thuộc vào độ bền của liên kết giữa các nguyên tử hoặc phân tử và cách chúng sắp xếp. Kim cương cực cứng vì liên kết cộng hóa trị giữa các nguyên tử Carbon rất mạnh và tạo thành mạng lưới không gian ba chiều bền vững.
- Độ dẫn điện: Ở kim loại, có những electron ở lớp vỏ ngoài cùng không bị giữ chặt bởi hạt nhân và có thể di chuyển tự do trong mạng lưới tinh thể nguyên tử kim loại. Dòng electron tự do này chính là dòng điện. Các chất không dẫn điện (chất cách điện) như nhựa, gỗ có các electron bị giữ chặt trong các liên kết hóa học của phân tử, không thể di chuyển tự do.
- Điểm nóng chảy, điểm sôi: Năng lượng (nhiệt độ) cần thiết để phá vỡ các lực liên kết giữa các phân tử (lực liên kết yếu) hoặc giữa các nguyên tử/ion trong mạng lưới (liên kết mạnh hơn). Chất có lực liên kết giữa các hạt yếu sẽ có điểm nóng chảy, sôi thấp (ví dụ: nước, cồn). Chất có lực liên kết mạnh sẽ có điểm nóng chảy, sôi cao (ví dụ: muối ăn, kim loại).
Hiểu được các nguyên lý này cho phép các nhà khoa học và kỹ sư thiết kế vật liệu phù hợp cho từng mục đích sử dụng, từ việc chọn kim loại phù hợp cho dây điện, đến việc phát triển polyme mới cho ngành công nghiệp nhựa.
Vai Trò Của Năng Lượng Trong Sự Tương Tác Của Nguyên Tử Và Phân Tử
Năng lượng đóng vai trò then chốt trong mọi sự tương tác giữa nguyên tử và phân tử. Sự hình thành liên kết hóa học giải phóng năng lượng (phản ứng tỏa nhiệt), trong khi phá vỡ liên kết lại cần năng lượng (phản ứng thu nhiệt).
Nhiệt độ chính là thước đo động năng trung bình của các hạt (nguyên tử, phân tử). Nhiệt độ càng cao, các hạt chuyển động càng nhanh và va chạm càng mạnh. Điều này giải thích tại sao các phản ứng hóa học thường xảy ra nhanh hơn ở nhiệt độ cao – các phân tử va chạm thường xuyên và mạnh hơn, dễ dàng phá vỡ liên kết cũ và hình thành liên kết mới.
Các trạng thái vật chất cũng phụ thuộc vào năng lượng. Khi cung cấp năng lượng (đun nóng), chất rắn có thể chuyển sang lỏng, rồi sang khí khi các phân tử có đủ năng lượng để vượt qua lực hút giữa chúng. Ngược lại, làm lạnh (giảm năng lượng) sẽ khiến chất khí chuyển sang lỏng, rồi sang rắn.
Sự tương tác giữa ánh sáng và vật chất cũng diễn ra ở cấp độ nguyên tử và phân tử. Electron trong nguyên tử có thể hấp thụ năng lượng từ photon ánh sáng và nhảy lên mức năng lượng cao hơn, hoặc phát ra photon khi quay về mức năng lượng thấp hơn. Đây là cơ chế đằng sau màu sắc của vật liệu và cách hoạt động của laser.
Hiểu về vai trò của năng lượng giúp chúng ta kiểm soát các quá trình hóa học và vật lý, từ việc tối ưu hóa hiệu suất nhà máy điện đến việc phát triển các nguồn năng lượng sạch.
Kết Luận
Qua hành trình khám phá thế giới vi mô, chúng ta đã thấy rằng phân tử và nguyên tử không chỉ là những khái niệm trừu tượng trong sách giáo khoa. Chúng là những “viên gạch” cấu tạo nên mọi vật chất, là nền tảng của mọi hiện tượng tự nhiên và là chìa khóa cho sự phát triển của khoa học và công nghệ hiện đại.
Từ cấu tạo kỳ diệu của nguyên tử với hạt nhân nhỏ bé và các electron chuyển động không ngừng, đến sự đa dạng vô tận của các loại phân tử được tạo thành từ sự kết hợp khác nhau của các nguyên tử – mỗi khía cạnh đều chứa đựng những nguyên lý khoa học sâu sắc. Việc nắm vững sự khác biệt và mối quan hệ giữa phân tử và nguyên tử mở ra cánh cửa hiểu biết về tính chất của vật chất, cách chúng tương tác và biến đổi.
Kiến thức này không chỉ hữu ích cho các nhà khoa học, kỹ sư, hay sinh viên. Nó giúp mỗi chúng ta có cái nhìn sâu sắc hơn về thế giới xung quanh, giải thích được vô vàn hiện tượng xảy ra hàng ngày, và thậm chí là đưa ra những lựa chọn thông minh hơn trong cuộc sống, từ việc sử dụng năng lượng hiệu quả đến việc hiểu về thành phần của thực phẩm chúng ta ăn.
Hãy tiếp tục giữ ngọn lửa tò mò và khám phá. Thế giới của phân tử và nguyên tử luôn sẵn sàng hé lộ những bí ẩn mới cho những ai kiên trì tìm hiểu.

